Содержание
Твердое, жидкое, газообразное – это три возможных состояния вещества – в чем разница между ними? Дело в том, что атомы и молекулы всегда находятся в движении. Даже в твердых веществах, например, в медной монете или куске бетона, они слегка вибрируют. Но в жидкостях атомы и молекулы движутся более интенсивно, чем в твердых веществах, а в газах – еще быстрее.

Твердые вещества
В твердых веществах атомы или молекулы расположены очень близко друг к другу. Они могут слегка колебаться, но практически остаются на одном месте. Когда же начинается воздействие высокой температуры, атомы и молекулы вибрируют интенсивнее, причем тем быстрее, чем выше температура. В конце концов вибрация становится столь сильной, что они могут начать смещаться со своего места. Когда это происходит, твердое тело плавится и становится жидкостью.

Жидкости
В жидкости атомы или молекулы перемещаются в любых направлениях, хотя их отдельные свободные группы могут сцепляться на короткое время. Основное различие между жидким и твердым веществами состоит в том, что в первых атомы или молекулы не привязаны к какому-то определенному месту. Они свободно двигаются. Поэтому жидкость может легко течь. На текучести основано свойство жидкостей не образование своей формы, а занятие свободного пространства, в том числе и пустого сосуда. Его форму жидкость и принимает. Атомы любого вещества вообще похожи на крохотные шарики, перемещающиеся с разной степенью свободы.
Газы
При нагревании жидкости отдельные атомы или молекулы переходят, так сказать, на новый энергетический уровень, получая столько энергии, что ее достаточно для того, чтобы оторваться от поверхности и превратиться в газ. В газообразном состоянии они перемещаются совершенно свободно. Когда газ подвергают воздействию высокой температуры, его атомы и молекулы летают быстрее. И еще одно свойство газов – за счет того, что между атомами и молекулами газа большие расстояния, он легко сжимается.
Плазма
Знаете ли вы, что существует четвертое агрегатное состояние вещества – плазма, – наблюдаемое довольно редко? Оно существует только при очень высоких температурах внутри Солнца и других звезд, а также на Земле при низких давлениях. Плазму образуют атомы, расщепленные под действием электричества или высоких температур.
При очень высоких температурах быстро движущиеся атомы газа сталкиваются друг с другом и распадаются на электроны и электрически заряженные атомы – ионы. Образующееся вещество и есть плазма.
Плазма обнаружена внутри звезд, где очень высокая температура. На поверхности Солнца, например, температура достигает 6 000°С, а в центре – 14 000 000°С. Плазма образуется также внутри пламени ядерного взрыва, где развивается температура 100 000 000 градусов, достаточно высокая, чтобы разорвать любой атом.
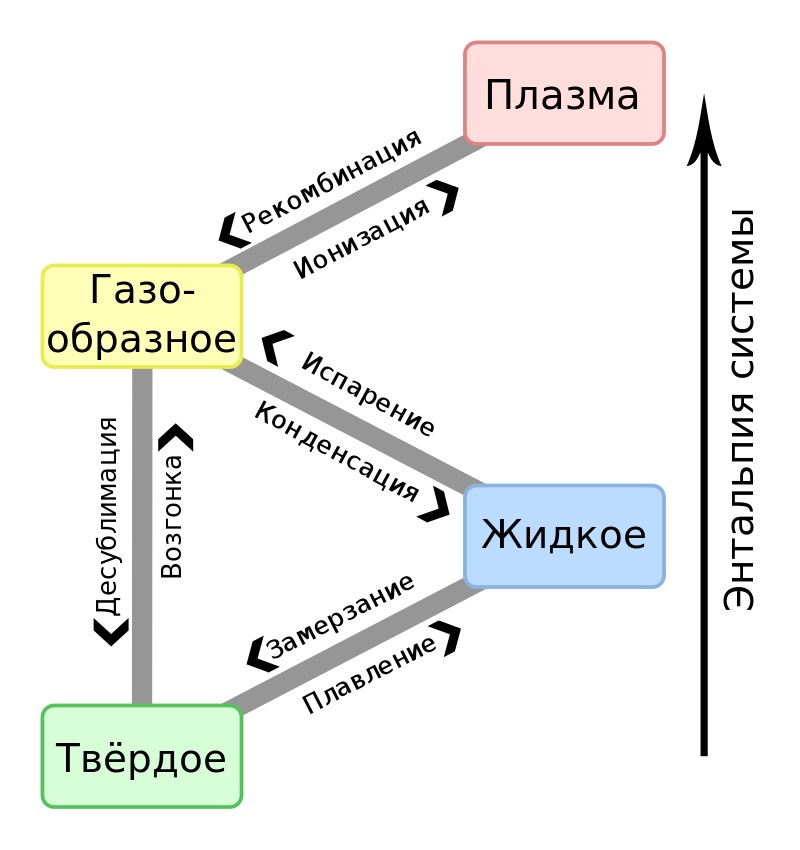
Твердое, жидкое, газообразное: когда вещество меняет свое состояние
Любое вещество может находиться в трех состояниях:
- твердом
- жидком
- газообразном
Например, вода при температуре от 0 до 100 °С находится в жидком состоянии. Ниже 0 °С она затвердевает и превращается в лед. Выше 100 °С начинает превращаться в пар. Все вещества при повышении температуры переходят из твердого состояния в жидкое, а затем в газообразное, так как с температурой возрастает энергия частиц, из которых состоит вещество, и они двигаются быстрее, утрачивая структурную связь друг с другом.

Переход от твердого состояния к жидкому называется плавлением, а от жидкого к газообразному – испарением. Обратный переход от газа к жидкости носит название конденсации, а от жидкости к твердому состоянию – застывания. Некоторые вещества из твердых сразу превращаются в газообразные. Такой переход называется возгонкой, или сублимацией.
Законы газов
Одним из первых ученых, изучавших сжатие газа, был Роберт Бойль. Уже в далеком 1662 году он доказал, что, если давление газа увеличить в два раза, его объем уменьшится вдвое. Произведение давления на объем есть величина постоянная для данной массы газа при постоянной температуре. Это правило называется законом Бойля.
Другой важный закон — закон Шарля (1787), который устанавливает зависимость расширения газа от его нагрева. Закон гласит, что если известен объем газа при 0°С, то он будет увеличиваться или уменьшаться на 1/273 часть своего объема при повышении или снижении температуры на один градус. При -273°С давление газа будет равно нулю, то есть это самая низкая возможная температура, называемая абсолютным нулем.
