Содержание
- 1 Что такое атомы и что такое молекулы
- 2 Как устроен атом: протоны, нейтроны и электроны
- 3 Атомы и молекулы: электронные оболочки
- 4 Кварки
- 5 Атомы и молекулы: образование молекул
- 6 Атомный номер
- 7 Элементы и соединения
- 8 Атомы и молекулы и периодическая система
- 9 Химические символы
- 10 Изотопы
- 11 Радиоактивность
Что такое атомы и что такое молекулы
Все во Вселенной, в том числе и планеты солнечной системы, и само солнце, и звезды, и целые галактики, состоит из крохотных частичек или кусочков материи, называемых атомами. Атомы и молекулы очень малы. Если 10 миллионов атомов расположить подряд один за другим, то длина этого ряда будет менее 1 мм. Атомы большинства веществ соединены вместе и образуют группы, которые называются молекулами. Обычно молекулы состоят из нескольких атомов, но есть и такие, которые содержат многие сотни или даже тысячи атомов.
Греческий философ Демокрит (ок. 460 – ок. 360 до н.э.) опередил развитие науки более чем на два тысячелетия, высказав предположение, что «вся материя состоит из бесконечного множества мельчайших невидимых частиц, неделимых и вечных». Таким образом, он является первым в истории автором атомистической теории, которую ученым далось экспериментально обосновать лишь в ХХ в. Первым создателем модели атома, состоящего из положительно заряженного плотного ядра, вокруг которого вращаются отрицательно заряженные электроны, стал британский физик Эрнст Резерфорд (1871-1937), удостоенный в 1909 г. Нобелевской премии.
Как устроен атом: протоны, нейтроны и электроны
Как устроен атом? Любое вещество – все, твердые тела, жидкости и газы – состоят из крохотных частиц – атомов. Увидеть атом можно только с помощью сверхмощного электронного микроскопа.
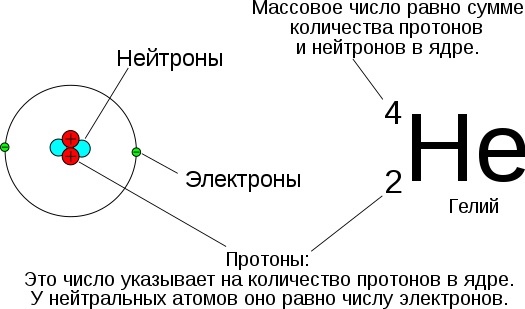
Строение атома подобно строению Солнечной системы. В центре располагается ядро, вокруг которого на разном расстоянии вращаются (правда, без фиксированной орбиты) электроны. Само ядро состоит из двух типов частиц: протонов и нейтронов. Абсолютно у каждого атома есть эта крошечная, но тяжелая центральная часть – ядро. Нейтронов нет только в атомах водорода.
Протоны имеют положительный электрический заряд, поэтому они притягивают к ядру электроны, заряженные отрицательно. Каждый электрон имеет электрический заряд, то есть несет очень маленькое количество электричества. Нейтроны же, как следует из названия, не имеют заряда. Число положительно и отрицательно заряженных частиц в атоме обычно одинаково, и атом в целом оказывается электрически нейтральным.
В противном случае он обладает положительным или отрицательным зарядом и называется ионом.
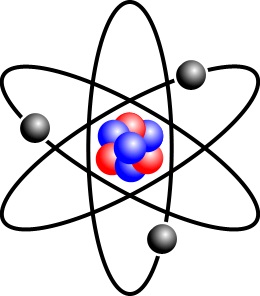
Знаете ли вы, что электроны в атоме сильно удалены от его ядра? Если сравнить атомное ядро с яблоком, то в масштабе таких величин электроны вращаются вокруг него на расстоянии около 1 километра!
Атомы и молекулы: электронные оболочки
Электроны в атоме распределяются по нескольким энергетическим уровням (слоям). Число электронов на внешнем уровне определяет химическую активность атома, то есть его способность образовывать связи с другими атомами. Так, атомы с полностью заполненным (насыщенным) внешним электронным уровнем химически стабильны. Напротив, атомы с недостающим числом электронов во внешнем слое стремятся установить связи с другими атомами, чтобы «сравнять счет».
Атом, потерявший электрон, и атом, приобретший лишний электрон, получают соответственно положительный и отрицательный электрический заряд. Они взаимно притягиваются друг к другу, образуя так называемую ионную связь. В другом случае, когда атомы с незаполненными внешними слоями объединяют свои электроны в пары, образуется ковалентная связь. В этом случае пара электронов двигается по общей орбите.
Траектории, или орбиты, электронов, вращающихся вокруг ядра, образуют несколько слоев, вроде слоев лука. В каждом слое, или оболочке, может быть определенное число электронов – на ближайшей к ядру оболочке – два электрона, на следующей – восемь и т.д.
Оболочка, которую образуют восемь электронов, очень стабильна (трудно разрушается). Поэтому такие вещества как неон, в атомах которых внешняя оболочка образована восемью электронами, трудно реагируют с другими веществами. Некоторые атомы могут приобрести стабильную внешнюю оболочку, образовав общую электронную пару с другими атомами,
Кварки
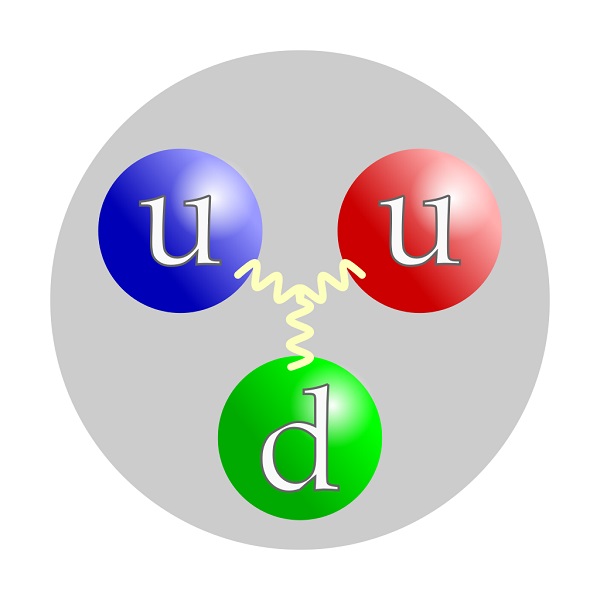
Современные ученые изучают внутреннее строение самих протонов и нейтронов с помощью пучка частиц высокой энергии. Опыты показали, что протоны и нейтроны состоят из еще более мелких частичек, названных кварками. Каждый протон и нейтрон содержат по три кварка.
Атомы и молекулы: образование молекул
Подобно тому как ноты или буквы, связываясь друг с другом, складываются в музыкальные аккорды или слова, в природе атомы одного или разных элементов соединяются в молекулы. Молекула – это самая мелкая структурная единица любого химического вещества. Например, молекула кислорода состоит из двух атомов кислорода и обозначается формулой О2 где О – символ химического элемента, а 2 – число его атомов.
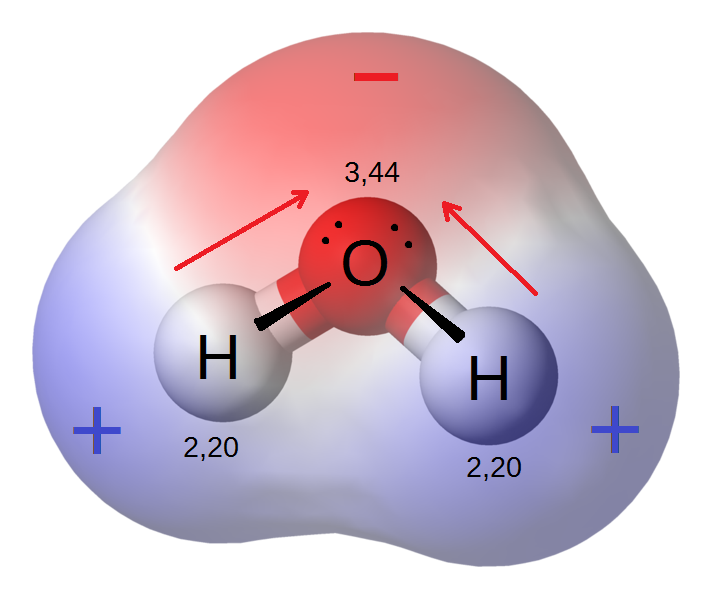
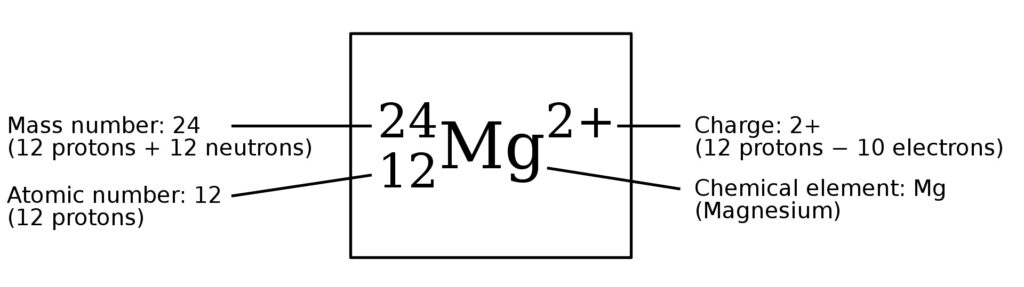
Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода и обозначается формулой Н2О. в которой указано % число атомов образующих ее элементов. Атомы соединяются друг с другом общими электронными парами.
Атомы и молекулы – суть одно в другом, как матрешка. При соединении атомов образуются молекулы. При этом происходит перераспределение, или обмен, электронов. Например, атом натрия может соединиться с атомом хлора, отдав свой электрон атому хлора. При этом у обоих атомов внешняя оболочка будет состоять из восьми электронов. Но в результате этого перемещения электронов на атомах образуются электрические заряды, притягивающие их друг к другу. Такой вид связи называется ионной.
Связь другого типа — ковалентная — возникает между атомами хлора. Обычно внешние оболочки этих атомов состоят из семи электронов. Но если два атома хлора сближаются, образуется общая для них электронная пара, содержащая по одному электрону от каждого атома. Такое расположение электронов приводит к заполнению внешней оболочки обоих атомов и формированию стабильной молекулы из двух атомов хлора,
Атомный номер
Число протонов в ядре обычно равно количеству электронов, вращающихся вокруг ядра, так что атом в целом оказывается незаряженным. Количество протонов в ядре атома называется атомным номером.
Частички, находящиеся в атомном ядре, обнаруживаются при бомбардировке ядра пучком электронов. Когда каждый отрицательно заряженный электрон проходит через ядро, он оставляет электрический след, который показывает, какого типа частичка встретилась на его пути.
Элементы и соединения
Любое вещество во Вселенной – или элемент, или соединение. Элемент – это вещество, состоящее из одного типа атомов. В настоящее время известно свыше сотни элементов.
Когда два или несколько элементов соединяются в результате химической реакции, атомы этих элементов объединяются, образуя молекулы, то есть новое соединение.
Таким образом, соединение — это атомы и молекулы, это вещество, которое состоит из разных атомов, объединенных в молекулы. Соединения по своим свойствам резко отличаются от элементов, входящих в их состав. Например, натрий — это металл, загорающийся при соприкосновении с водой, а хлор ядовитый желтый газ. Однако при взаимодействии этих двух элементов образуется совершенно безопасное соединение — обычная соль.

Атомы и молекулы и периодическая система
Если все элементы расположить в ряд в соответствии с их атомными номерами, то элементы со сходными свойствами окажутся в определенных местах этого ряда. Это подобие легко заметить, построив таблицу, или диаграмму, которая называется периодической системой.
В периодической системе элементы со сходными свойствами располагаются в вертикальных столбцах. Например, гелий, неон, аргон, криптон, ксенон и радон занимают правый столбец. Все эти газы, довольно близкие по свойствам, называются инертными, потому что они очень трудно вступают в реакции. При этом в самой верхней клетке – самые инертные элементы, чем ниже клетка в столбце, тем более реакционно способен элемент (то есть тем легче он вступает в реакцию). Самые химически активные элементы расположены в столбцах, начинающихся литием и фтором.
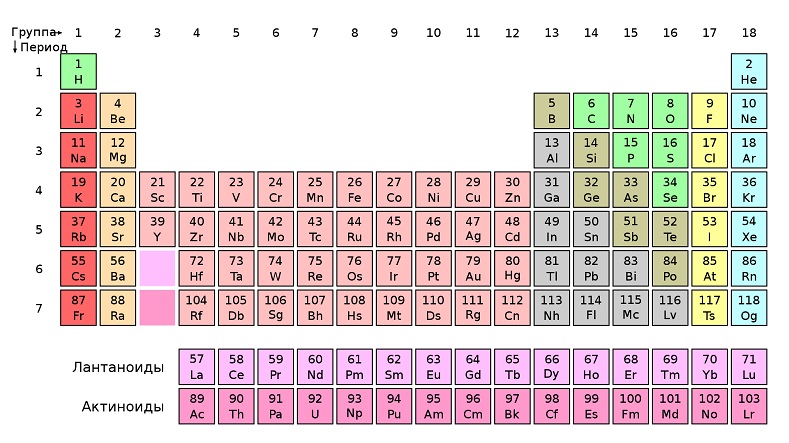
Положение элемента в периодической системе определяется тем, как его электроны размещены вокруг ядра. Инертные (нереакционноспособные) газы имеют стабильную внешнюю оболочку электронов.
У химически активных элементов левого столбца нестабильная внешняя оболочка, состоящая из единственного электрона.
Химические символы
Для изображения элементов ученые используют символы, состоящие из одной или двух букв. Символ водорода – Н, кислорода – О. Те же символы применяются для изображения элементов в соединении. Например, вода —это вещество, молекулы которого состоят из двух атомов водорода и одного атома кислорода. Поэтому молекула воды обозначается Н2О.
Для изображения химических реакций используются те же символы. Взаимодействие водорода и кислорода с образованием воды записывается так: 2Н); + О. —> 2Н.О. Эта запись показывает, что две молекулы водорода, содержащие по два атома, соединяются с одной молекулой кислорода, состоящей тоже из двух атомов, в результате чего получаются две молекулы воды.
Изотопы
Ученые установили, что атомы одного и того же элемента всегда имеют одинаковое количество протонов в ядре, но количество нейтронов может быть разным. Атомы, имеющие одинаковое число протонов, но разное количество нейтронов, называются изотопами. Каждый элемент имеет несколько изотопов. У водорода, например, их три.
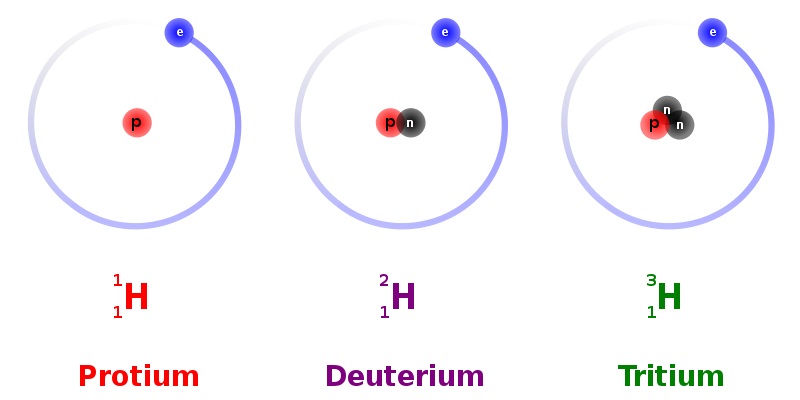
В ядре наиболее известного изотопа водорода всего один протон и нет ни одного нейтрона. В изотопе дейтерия – один нейтрон, а в изотопе трития – два.
Радиоактивность
Ядра многих изотопов стабильны и неизменны. Но есть и нестабильные изотопы, называемые радиоактивными. Они излучают энергию в форме радиации и переходят в более стабильное состояние. Радиоактивные изотопы могут выделять три типа радиации.
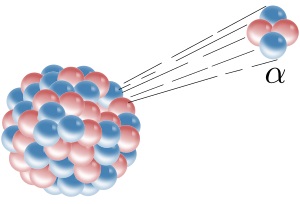
Альфа-излучение состоит из крошечных частиц, называемых альфа-частицами, которые содержат два протона и два нейтрона. Второй вид радиации – бета-излучение, состоящее из электронов высокой энергии. И третий – гамма-излучение, или рентгеновские лучи высокой энергии.

